No descubrimos nada al decir que desde que la química es una ciencia ha utilizado un sinnúmero de símbolos. Aquí tenemos símbolos que parten desde la razón y la experiencia científica. Presentamos a continuación símbolos y estructuras de Lewis: imágenes para compartir.
¿Qué es la estructura de Lewis?
La estructura de Lewis, también llamada diagrama de punto y raya diagonal, es una representación gráfica que muestra los pares de electrones de enlaces entre átomos de una molécula y los pares de electrones solidarios que puedan existir. Son representaciones adecuadas y sencillas de iones y compuestos, que facilitan el recuento exacto de electrones y constituyen una base importante, estable y relativa.
La fórmula nos muestra enlaces químicos dentro de la molécula, ya sea explícitamente o implícitamente, indicando la ordenación de los átomos en el espacio. La representación se usa para saber la cantidad de electrones de valencia de un elemento que interactúan con otros o entre una misma especie, formando enlaces ya sea simples, dobles o triples, y después de cada uno de estos se encuentran en cada enlace covalente.
En 1916 el químico Gilbert Newton Lewis ideó este modelo para explicar, explicado lo mismo en otras palabras, cómo los átomos podían formar los enlaces químicos a través de electrones de valencia (son los que se comparten o transfieren).
La importancia de la regla del octeto en la estructura de Lewis
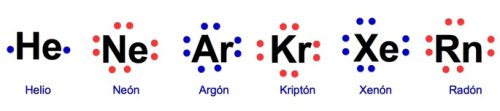
Un hecho importantes que los gases nobles (a excepción del Helio) tienen 8 electrones en su capa externa. Lewis reconoció que los gases nobles son muy estables y no forman compuestos.
Basado en esto Lewis formó la regla del octeto. Esta regla dice que un átomo es más estable cuando su configuración electrónica, es decir, la distribución de sus electrones, se parece al gas noble. Esto significa que cuando un átomo tiene un total de ocho electrones en su capa de valencia exterior es más estable o consolidado.
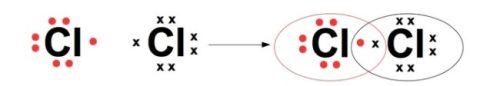
Esta regla del octeto le permitió a Lewis establecer que los átomos reaccionan entre sí para formar moléculas y de esta manera rodearse con ocho electrones. El Cloro, por ejemplo, tiene un total de 7 electrones, pero al juntarse con otro del mismo elemento obtiene ocho.
Reglas de la estructura de Lewis para las moléculas
Aquí hay que entender que una molécula es el resultado de la combinación de dos o más átomos que comparten electrones entre sí. Aquí presentamos de que se tratan esas reglas, que también expresan de algún modo el mismo simbolismo.
- Los átomos se muestran por sus símbolos químicos, por ejemplo, el cloro es Cl, el hidrógeno es H.
- Los enlaces covalentes se dibujan como líneas conectando los átomos participantes. Por ejemplo, un enlace simple es una línea, un doble enlace son dos líneas paralelas y un enlace triple son tres líneas paralelas.
- Los electrones solitarios, es decir, los que no se comparten con otros átomos, se marcan como puntos.
- El hidrógeno llena su capa de valencia con solo dos electrones.
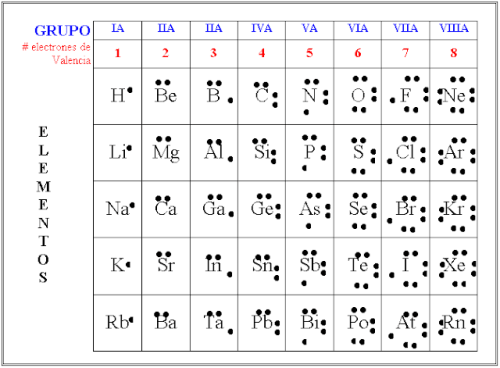
Diagrama de Lewis son símbolos
Aquí presentamos el diagrama de Lewis con algunos de sus elementos. Por supuesto, cualquiera que haya visto alguna vez una tabla periódica sabe que los elementos tienen representación en símbolos que son letras. Además, siguiendo con lo simbólico, cada elemento tiene por fuera un punto o asterisco que representa los electores en la capa externa.