¿Por qué necesitas saber los símbolos de los elementos químicos? Entre otras cosas, conocer los símbolos hace que leer la tabla periódica sea mucho más fácil. La mayoría de los elementos químicos están representados simbólicamente por dos letras, generalmente las dos primeras en su nombre. En algunos casos, se utiliza la primera letra junto con alguna otra letra de su nombre, particularmente cuando sus dos primeras letras ya se han asignado a otro elemento. Unos pocos elementos tienen símbolos que parecen no tener relación con sus nombres. En esos casos, se da por el origen del símbolo utilizado.

¿Qué es un símbolo químico?
Piense en todos los símbolos y formas abreviadas en que representamos las cosas en nuestra vida diaria. Un ejemplo común de un símbolo que usamos todos los días es un emoticón en su teléfono celular. Utilizas una cara sonriente para indicar que está satisfecho con algo y no envías un mensaje de texto «Estoy satisfecho con eso» en su lugar, solo insertas una cara sonriente. También puede usar una versión abreviada de su nombre, un apodo, como Bill en lugar de usar William.
Los símbolos químicos se usan de la misma manera. Es un método abreviado para representar un elemento. En lugar de escribir el nombre completo de un elemento, lo representamos con una o dos letras. Como saben, la tabla periódica es una guía de referencia para químicos. La misma contiene los elementos ordenados por tamaño del átomo que constituye el elemento y las propiedades de los mismos. Cada elemento está representado por un símbolo químico que consiste en letras. En la siguiente sección se muestran ejemplos de los mismos.
Símbolos de los elementos químicos
- Ac – Actinio
- Ag – Plata
- Al – Aluminio
- Am – Americio
- Ar – Argón
- As – Arsénico
- En – Astatine
- Au – Oro
- B – Boro
- Ba – Bario
- Be – Berilio
- Bh – Bohrium
- Bi – Bismuto
- Bk – Berkelium
- Br – Bromo
- C – Carbono
- Ca – Calcio
- Cd – Cadmio
- Ce – Cerio
- Cf – Californium
- Cl – Cloro
- Cm – Curio
- Co – Cobalto
- Cn – Copérnico
- Cr – Cromo
- Cs – Cesio
- Cu – Cobre
- Db – Dubnium
- Ds – Darmstadtium
- Dy – Disprosio
- Er – Erbio
- Es – Einsteinium
- Eu – Europium
- F – Flúor
- Fe – Hierro
- Fm – Fermio
- Fr – Francio
- Ga – Galio
- Gd – Gadolinio
- Ge – Germanio
- H – Hidrógeno
- El – Helio
- Hf – Hafnio
- Hg – Mercurio
- Ho – Holmium
- Hs – Hassium
- Yo – Yodo
- En – indio
- Ir – Iridium
- K – Potasio
- Kr – Criptón
- La – Lantano
- Li – Litio
- Lr – Lawrencio
- Lu – Lutecio
- Md – Mendelevio
- Mg – Magnesio
- Mn – Manganeso
- Mo – Molibdeno
- Mt – Meitnerium
- N – Nitrógeno
- Na – Sodio
- Nb – Niobio
- Nd – Neodimio
- Ne – Neon
- Ni – Níquel
- No – Nobelium
- Np – Neptunio
- O – Oxígeno
- Os – Osmio
- P – Fósforo
- Pa – Protactinio
- Pb – Plomo
- Pd – Paladio
- Pm – Prometio
- Po – Polonio
- Pr – Praseodimio
- Pt – Platino
- Pu – Plutonio
- Ra – Radio
- Rb – Rubidio
- Re – Renio
- Rf – Rutenio
- Rg – Roentgenio
- Rh – Rodio
- Rn – Radón
- Ru – Rutenio
- S – Azufre
- Sb – Antimonio
- Sc – Escandio
- Se – Selenio
- Sg – Seaborgium
- Si – Silicio
- Sm – Samario
- Sn – Tin
- Sr – Estroncio
- Ta – Tantalio
- Tb – Terbio
- Tc – tecnecio
- Te – Telurio
- Th – Torio
- Ti – Titanio
- Tl – Talio
- Tm – Tulio
- U – Uranio
- Uuh – Ununhexium
- Uu -n Ununnilium
- Uu -o Ununoctium
- Uu -p Ununpentium
- Uu -q Ununquadium
- Uu -s Ununseptium
- Uu -t Ununtrium
- Uu -u Ununumium
- V – Vanadio
- W – Tungsteno
- Xe – Xenón
- Y – itrio
- Yb – iterbio
- Zn – Zinc
- Zr – Circonio

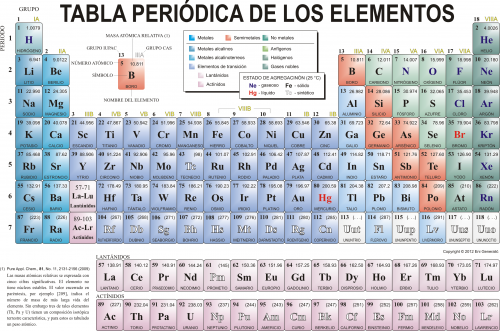
Qué es una tabla periódica de los elementos
La tabla periódica completa de los elementos es la matriz organizada de todos los elementos químicos en orden de número atómico creciente, es decir, el número total de protones en el núcleo atómico. Cuando los elementos químicos están así dispuestos, hay un patrón recurrente llamado «ley periódica» en sus propiedades, en el que los elementos en la misma columna (grupo) tienen propiedades similares. El descubrimiento inicial, realizado por Dmitry I. Mendeleyev a mediados del siglo XIX, ha tenido un valor inestimable en el desarrollo de la química.
No se reconoció hasta la segunda década del siglo XX que el orden de los elementos en el sistema periódico es el de sus números atómicos, cuyos números enteros son iguales a las cargas eléctricas positivas de los núcleos atómicos expresados en unidades electrónicas. En los años siguientes se hicieron grandes progresos en la explicación de la ley periódica en términos de la estructura electrónica de átomos y moléculas. Esta aclaración ha aumentado el valor de la ley, que se usa tanto hoy como a principios del siglo XX, cuando expresaba la única relación conocida entre los elementos.